La présente étude a pour objectif de déterminer si la promotion de la prolifération cellulaire constitue l’un des phénomènes participant à la régénération tissulaire induite par le CRET, à une densité de courant sous-thermique, dans les cellules souches issues du tissu adipeux (ADSC), un type de CSM.
INTRODUCTION
Les précurseurs jouent un rôle essentiel dans la régénération des tissus. Suite à la prolifération, les nouvelles cellules retrouvent la fonction d’origine des tissus. Les cellules souches mésenchymateuses (CSM) forment un groupe de cellules clés, qui participent à la phase proliférative de la régénération des lésions et sont présentes dans la quasi-totalité des tissus adultes.
Traditionnellement, les physiothérapies reposant sur la stimulation électrique ou électromagnétique produisent des résultats satisfaisants dans le domaine de la régénération de lésions tissulaires traumatiques ou dégénératives, ainsi qu’en médecine esthétique (1-7). Parmi ces thérapies, le transfert d’énergie capacitive et résistive (CRET) est une stratégie électrothermique non invasive, reposant sur l’application de courants électriques sur une plage de radiofréquence comprise entre 400 kHz et 450 kHz. De récentes études in vitro indiquent qu’administré à des densités thermiques, le CRET est cytotoxique pour les cellules cancéreuses humaines, cet effet thermique étant amplifié par l’injection de microparticules métalliques dans les tissus cancéreux ciblés (8). Au niveau cellulaire, le CRET ne produit pas seulement des effets thermiques ; à des doses sous-thermiques (non chauffantes), il peut induire des réponses anti-prolifératives et cytotoxiques dans des lignées cellulaires cancéreuses humaines mises en culture, mais pas au sein des cultures primaires de cellules mononuclées du sang périphérique humain (9-13). Ces résultats expérimentaux peuvent être interprétés comme étayant la preuve que les effets des thérapies médicales par CRET ne sont pas exclusivement dus à la hausse de température, mais aussi aux réponses cellulaires directes au stimulus électrique lui-même. Concernant la régénération des tissus, la thérapie CRET est actuellement utilisée en rééducation physique et en médecine du sport, pour traiter les lésions musculaires, osseuses, ligamentaires et tendineuses (14-16). La récupération plus rapide après une blessure permise par le CRET se manifeste par une réduction générale de l’extension de la zone lésée, ainsi que des processus anti-inflammatoires, une analgésie et une récupération de la fonction musculaire (17-20). La présente étude a pour objectif de déterminer si la promotion de la prolifération cellulaire constitue l’un des phénomènes participant à la régénération tissulaire induite par le CRET, à une densité de courant sous-thermique, dans les cellules souches issues du tissu adipeux (ADSC), un type de CSM.
MATÉRIEL ET MÉTHODES
Culture cellulaire
Les cellules souches issues du tissu adipeux ont été isolées des échantillons de graisse sous-cutanée de quatre donneurs en bonne santé (deux hommes de 65 et 69 ans, ainsi que deux femmes de 29 et 35 ans). Des ADSC des passages trois à huit ont été utilisées dans ces expériences.
Exposition au CRET
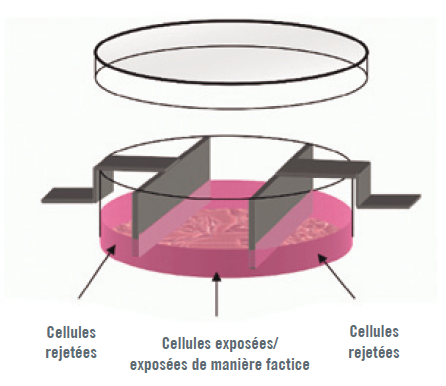
L’exposition des cellules (comme dans l’Illustration 1) aux courants CRET se composait d’impulsions de 448 kHz pendant 5 minutes à une densité sous-thermique de 50 μA/mm2, séparées par des intervalles de 4 heures, sur une durée totale de 48 heures. Dans de précédentes études menées par notre groupe, ces paramètres d’exposition ont infl ué sur la prolifération cellulaire (9-13). Les cultures ont été placées dans des incubateurs et surveillées en continu. Pendant l’exposition factice, les paires d’électrodes introduites dans les cultures de contrôle ont également été connectées au générateur, mais sans être mises sous tension.
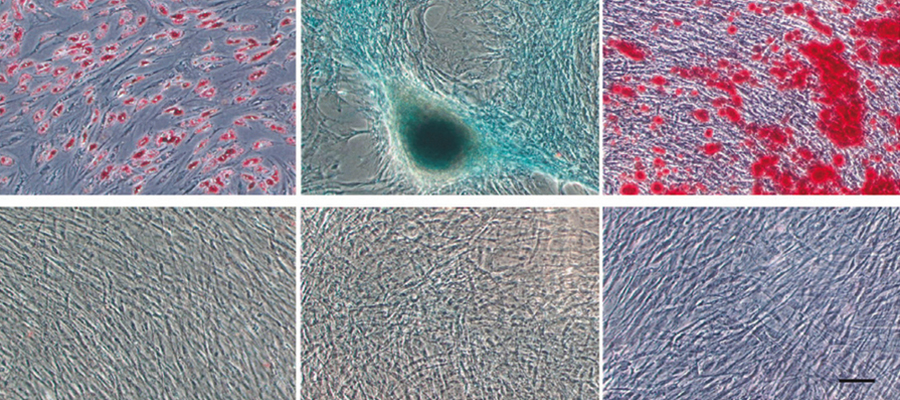
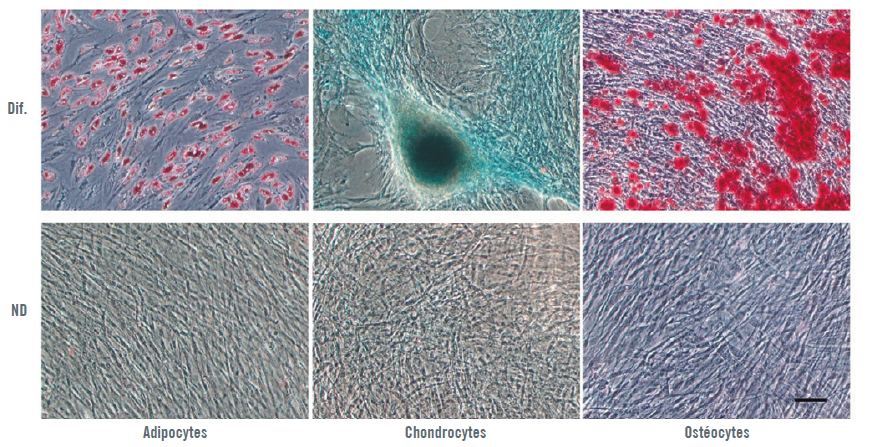
Test de différenciation pour la caractérisation mésenchymateuse
Pour déterminer la multipotentialité différenciative des ADSC obtenues, les cellules ont été incubées dans un milieu adipogène, chondrogène ou ostéogène. Au jour 15 d’incubation dans le support de différenciation correspondant, les ADSC ont été fixées afin d’évaluer la différenciation adipogène, chondrogène ou ostéogène. La même procédure d’évaluation de la différenciation a été appliquée pour déterminer si la multipotentialité des ADSC pouvait être affectée par l’exposition au CRET.
Évaluation de la prolifération cellulaire
L’effet du CRET sur la prolifération cellulaire a été déterminé par un test colorimétrique XTT et par quantification de la synthèse de l’ADN en détectant la 5-bromodéoxyuridine (BrdU) incorporée au moyen de l’immunofluorescence.
Analyse du cycle cellulaire
Les effets potentiels du traitement sur le cycle cellulaire ont été évalués par cytométrie de fl ux, grâce à des cultures au niveau des passages P3 et P4. Pour savoir quelles cellules passent par les phases S et G2 du cycle cellulaire, on a utilisé l’antigène nucléaire des cellules prolifératives (PCNA), un marqueur protéique associé à l’ADN-polymérase (21).
RÉSULTATS
Différenciation adipogène, chondrogène et ostéogène des ADSC
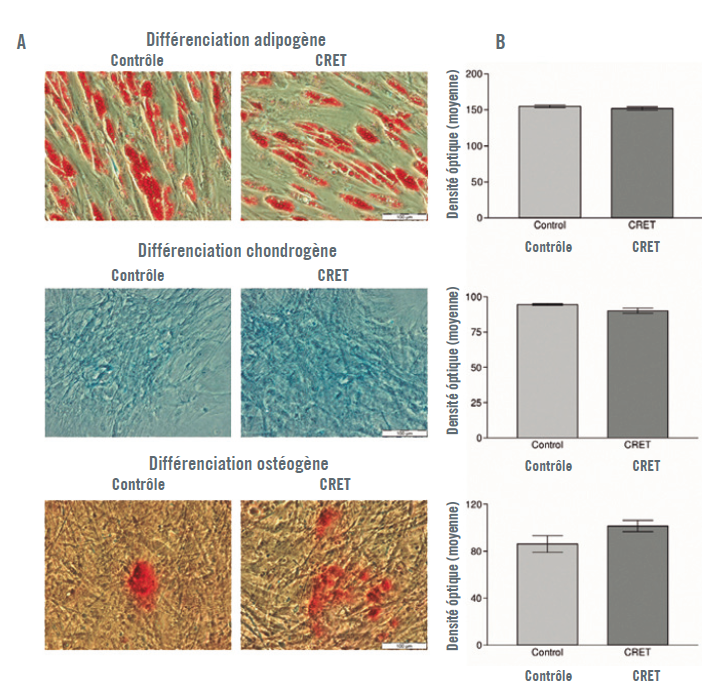
Les ADSC ont présenté des modèles de différenciation clairs dans les trois lignées cellulaires étudiées : adipocytes, chondrocytes ou ostéocytes (Illustration 2).
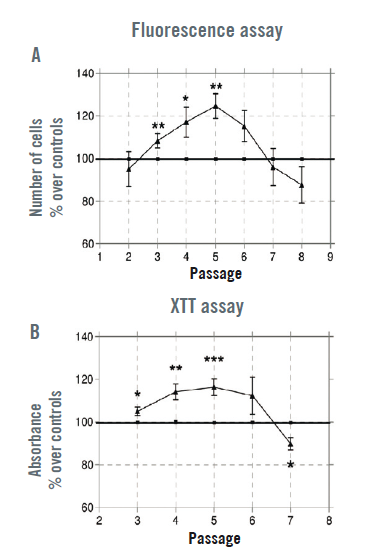
Prolifération par CRET
L’effet du CRET a été dépendant du passage de la culture. La numération des ADSC traitées sur les passages P3 à P5 a augmenté significativement, pour atteindre une hausse maximale de 25 % par rapport aux contrôles exposés de manière factice sur le passage P5 (Illustration 3A). Le test colorimétrique XTT a confirmé que la hausse du nombre de cellules avait atteint 20 % par rapport aux contrôles dans les cultures traitées sur les passages P3 à P5 (Illustration 3B).
Analyse du cycle cellulaire
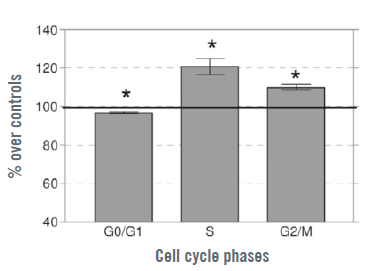
Concernant les effets du CRET sur le cycle cellulaire, sur les passages P3 à P5, on a observé une diminution modeste (3 %), mais statistiquement significative de la proportion de cellules en phase G0/G1, accompagnée de hausses statistiquement significatives (21 % et 10 % par rapport aux contrôles) de cellules respectivement en phases S et G2/M (Illustration 4). Ces données ont été étayées par la numération des cellules positives selon la technique PCNA, le CRET ayant mis en évidence une hausse statistiquement significative (35 %) par rapport aux contrôles.
Multipotentialité des ADSC après traitement par CRET
Après deux semaines d’incubation post-exposition, en présence du support de différenciation correspondant, les modèles de différenciation des échantillons exposés au CRET n’ont pas présenté de différence significative par rapport aux contrôles (Illustration 5).
CONCLUSIONS
Les présents résultats démontrent que l’exposition intermittente à un stimulus électrique de 448 kHz appliqué dans le cadre de thérapies par transfert d’énergie capacitive et résistive (CRET) augmente le pourcentage de cellules en phases S, G2 et mitose, et favorise la prolifération des cellules souches mésenchymateuses humaines. Les résultats obtenus indiquent que le traitement électrique CRET peut favoriser la régénération des tissus en activant la prolifération de cellules souches issues de tissus adipeux (ADSC) au repos présentes dans la zone lésée, sans compromettre la multipotentialité des cellules souches en vue de la différenciation adipogène, chondrogène ou ostéogène. Ces données, ainsi que la preuve expérimentale précédemment publiée, soutient fortement Densité óptique (moyenne) Densité óptique (moyenne) Densité óptique (moyenne) l’hypothèse selon laquelle des mécanismes moléculaires et cellulaires autres que les effets thermiques peuvent être essentiels pour l’efficacité thérapeutique des traitements par CRET, y compris pour la réparation des tissus.
En résumé, les résultats regroupés ici indiquent que le traitement électrique CRET pourrait favoriser ou accélérer la réparation des lésions en stimulant la prolifération de cellules souches s’étendant déjà. On peut donc envisager le CRET comme un adjuvant efficace pour la récupération de diverses lésions tissulaires et vasculaires ou en tant que traitement optionnel de patients sensibles aux effets indésirables de certaines chimiothérapies. Le CRET peut également s’avérer utile dans le cadre de traitements anti-inflammatoires.
AUTEURS
HERNANDEZ-BULE, PAINO CL, TRILLO MA, UBEDA A. CELL PHYSIOL BIOCHEM 2014; 34:1741-1755
BIBLIOGRAPHIE
1 Messerli MA, Graham DM: Extracellular electrical fields direct wound healing and regeneration. Biol Bull 2011;221:79-92.
2 Pilla AA: Nonthermal electromagnetic fields: From first messenger to therapeutic applications. Electromagn Biol Med 2013;32:123-136.
3 Belenky I, Margulis A, Elman M, Bar-Yosef U, Paun SD: Exploring channeling optimized radiofrequency energy: A review of radiofrequency history and applications in esthetic fields. Adv Ther 2012;29:249-266.
4 Boyette MY, Herrera-Soto JA: Treatment of delayed and nonunited fractures and osteotomies with pulsed electromagnetic field in children and adolescents. Orthopedics 2012;35:e1051-1055.
5 Whipple TL: From mini-invasive to non-invasive treatment using monopolar radiofrequency: The next orthopaedic frontier. Orthop Clin North Am 2009;40:531-535, x.
6 Conner-Kerr T, Isenberg RA: Retrospective analysis of pulsed radiofrequency energy therapy use in the treatment of chronic pressure ulcers. Adv Skin Wound Care 2012;25:253-260.
7 Lolis MS, Goldberg DJ: Radiofrequency in cosmetic dermatology: A review. Dermatol Surg 2012;38:1765- 1776.
8 San BH, Moh SH, Kim KK: Investigation of the heating properties of platinum nanoparticles under a radiofrequency current. Int J Hyperthermia 2013;29:99-105.
9 Hernandez-Bule ML, Trillo MA, Bazan E, Martinez-Pascual MA, Leal J, Ubeda A: Nonthermal levels of electric currents applied in capacitive electric transfer therapy provokes partial cytotoxic effects in human neuroblastoma cultures. Neurocirugia (Astur) 2004;15:366-371; discussion 371.
10 Hernandez-Bule ML, Trillo MA, Cid MA, Leal J, Ubeda A: In vitro exposure to 0.57 MHz electric currents exerts cytostatic effects in HepG2 human hepatocarcinoma cells. Int J Oncol 2007;30:583-592.
11 Hernandez-Bule ML, Cid MA, Trillo MA, Leal J, Ubeda A: Cytostatic response of HepG2 to 0.57 MHz electric currents mediated by changes in cell cycle control proteins. Int J Oncol 2010;37:1399-1405.
12 Hernandez-Bule ML, Roldan E, Matilla J, Trillo MA, Ubeda A: Radiofrequency currents exert cytotoxic effects in NB69 human neuroblastoma cells but not in peripheral blood mononuclear cells. Int J Oncol 2012;41:1251-1259.
13 Hernandez-Bule ML, Trillo MA, Ubeda A: Molecular mechanisms underlying antiproliferative and differentiating responses of hepatocarcinoma cells to subthermal electric stimulation. PLoS One 2014;9:e84636.
14 Ganzit GP, Stefanini L, Stesina G: Nuove methodice nei trattamento della patología muscolo-articolare dell´atleta: La tercaterapia. Med Sport 2000;53:361-367.
15 Melegati G, Volpi P, Tornese D, Mele G: Rehabilitación en patologías del tendón. Revista del Deporte, Investigación de traumatología e investigacionesafines 1999;21:66-83.
16 Mondardini P, Tanzi R, Verardi L, Briglia S, Maione A, Draco E: Nuove metodologíanel trattamento della patología muscolare traumática dell´atleta. Med Sport 1999;52:201-213.
17 Takahashi K ST, Onodera M, Hirabayashi S, Tsuzuki N, Zhong-Shi L: Clinical effects of capacitive electric transfer hyperthermia therapy for lumbago. J Phys Ther Sci 1999;11
18 Takahashi K ST, Onodera M, Hirabayashi S, Tsuzuki N, Zhong-Shi L: Clinical effects of capacitive electric transfer hyperthermia therapy for cervico-omo-brachial pain. J Phys Ther Sci 2000;12:43-48.
19 Arnedo F, Andrew A, Till L, Sendrós S, Hellín S: Radiofrecuencia monopolar capacitiva/resistiva 448 kHz (indiba activ therapy) en el tratamiento rehabilitador de lesiones de la musculatura isquitibial derivada de la práctica deportiva: XIV Congreso Nacional de la Federación Española de Medicina del Deporte. Santander, Spain, 2012, XXIX, pp 915.
20 Sust F, Linde X, Sendrós S, Figueras G, Till L: Radiofrecuencia monopolar capacitiva/resistiva 448 kHz (indiba activ therapy) en el tratamiento de lesiones músculo-tendinosas: XIV Congreso Nacional de la Federación Española de Medicina del Deporte. Santander, Spain, 2012, XXIX, pp 915.
21 Woods AL, Hall PA, Shepherd NA, Hanby AM, Waseem NH, Lane DP, Levison DA: The assessment of proliferating cell nuclear antigen (PCNA) immunostaining in primary gastrointestinal lymphomas and its relationship to histological grade, S, G2, M phase fraction (fl ow cytometric analysis) and prognosis. Histopathology 1991;19:21-27.